Resultaten

De metingen die we hebben gedaan kun je hiernaast in de afbeelding zien. Hieronder vind je het document met de hele opdracht uitgewerkt. Onze resultaten kun je vinden als je verder naar beneden scrolt.
Verwerking resultaten
De concentratie in de voorraadfles van natriumthiosulfaat is 0,1 mol/L. We hebben de concentratie van het thiosulfaat uitgerekend en die hebben we hieronder in de tabel geplaatst. Wanneer deze concentratie berekend wordt, moet er niet vergeten worden dat men rekening moet houden met het HCl dat in de oplossing zit.
We hebben naast de concentratie van thiosulfaat ook de wachttijd in de tabel gezet. Deze wachttijd geeft aan hoe lang het duurde voordat de reactie een E van 0,8 heeft bereikt.
Buis Thiosulfaatconcentratie (mol/l) Wachttijd (s) 1/ tijd (s-1)
1 0,01 321,6 0,0031
2 0,02 109,2 0,0092
3 0,03 58,2 0,017
4 0,04 39,2 0,026
Afbeelding 1. We hebben in de grafiek (afbeelding 1) de wachttijd tegenover de concentratie van thiosulfaat gezet. In de grafiek is te zien, dat wanneer de concentratie thiosulfaat hoger is, dat dan de reactie ook sneller verloopt. Op de verticale as ligt de tijd in seconden en op de horizontale as ligt de concentratie van thiosulfaat in mol per liter.
Afbeelding 2. De reciproke (omgekeerde) waarde van de wachttijd (1/t) is gelijk te stellen aan de reactiesnelheid van het reactiemengsel. Deze reciproke hebben we ook berekend. In de grafiek (afbeelding 2) kun je dan ook de reciproke wachttijd tegenover de concentratie van thiosulfaat. Wat heel duidelijk te zien is in de grafiek is het verband tussen de reciproke wachttijd en de concentratie thiosulfaat. Je kunt namelijk zien dat er een lineair verband in terug te vinden is.
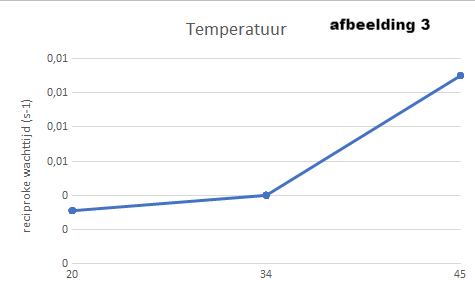
Afbeelding 3. Als laatste hebben we de resultaten nog verwerkt in een grafiek met de reciproke wachttijd tegenover de temperatuur. We hebben de temperatuur van de buisjes 1, 5 en 6 hiervoor gebruikt. De reactiesnelheid gaat namelijk sneller wanneer de temperatuur hoger wordt. Dit komt doordat de moleculen sneller bewegen als het warmer is. En wanneer de moleculen sneller bewegen, zullen er meer botsingen plaatsvinden. En als er meer botsingen plaatsvinden dan heb je een snellere reactie.
Deze grafiek (afbeelding 3) heeft niet helemaal hetzelfde verband als de grafiek hierboven (afbeelding 2). Wel gaat ook deze grafiek steeds verder omhoog, maar het verband in deze grafiek is niet lineair.


Maak jouw eigen website met JouwWeb